PRESS RELEASE
2016年10月17日
株式会社富士通システムズ・イースト
医薬品の試験データ検証ツール「Pinnacle 21 Enterprise」提供開始
2016年10月から開始した電子申請に対応し、医薬品申請の負荷を大幅に軽減
株式会社富士通システムズ・イースト(本社:東京都港区、代表取締役社長:石川 享)は、製薬企業などが医薬品の電子申請を行う際に医薬品医療機器総合機構(以下、PMDA)に提出する試験データの品質を検証するためのサービス「Pinnacle 21 Enterprise(ピナクル21エンタ-プライズ)」を10月17日より提供開始します。
電子申請では、CDISC(Clinical Data Interchanges Standards Consortium 注1)が定める標準に準拠した試験データの提出が必要になります。本サービスでは、試験データをアップロードするだけで、CDISC標準への準拠性をわずか数分(注2)で検証し可視化します。これにより、製薬企業などは、CDISC標準に確実に準拠したデータをPMDAに提出できるため、申請後のデータ修正などの手戻りを防止し、承認期間の短縮につなげることができます。
米国で実施されている医薬品の電子申請が2016年10月から日本でも開始され、2020年には義務化される予定です。電子申請では、CDISCが定める標準に準拠した臨床試験データが提出されるようになり、より詳細な試験データが規制当局に集積されます。これらのデータは、日本の医療福祉の発展に向けて、製薬企業や研究機関などの医薬品開発において活用される予定であり、開発効率や成功率の向上につながることが期待されています。
一方、製薬企業や研究機関はCDISC標準への準拠性を確実に検証した上で試験データを提出するために、英文で数百ページにおよぶCDISCの実装ガイドを参照しながら確認する必要がありますが、多大な負荷を要するとともに、目視で確認することは大変困難であり現実的ではありません。
そこで当社は、米国の規制当局 Food and Drug Administration (以下、FDA)や大手製薬企業において高い導入実績をもつ試験データの品質検証・管理ツール「Pinnacle 21 Enterprise」を販売するPinnacle 21 LLC(本社:米国ペンシルベニア州フィラデルフィア郊外、CEO:Max Kanevsky)と販売契約を締結し、日本で唯一本サービスの提供を開始します。
富士通グループでは、CDISC標準に準拠した臨床試験データを容易に作成・管理するシステムとして「tsClinical Metadata」を提供しており、「Pinnacle 21 Enterprise」と合わせて、製薬企業の医薬品申請業務を強力に支援します。
【「Pinnacle 21 Enterprise」の主な特長】
- 国際標準への準拠性を複数の指標で測定
医薬品開発データの国際標準であるCDISCの実装ガイドでは、表記項目から、用語、データの格納方法やそれらデータの解析モデル表記にわたり詳細に規定されています。「Pinnacle 21 Enterprise」では、試験データがCDISCに準拠しているかどうかを複数の視点できめ細かく検証し、ダッシュボード画面で視覚的にわかりやすく表示します。これにより、申請前に課題を発見しデータの精度を高めることができるため、申請の手戻りを防止し審査の遅延を防ぐことができます。
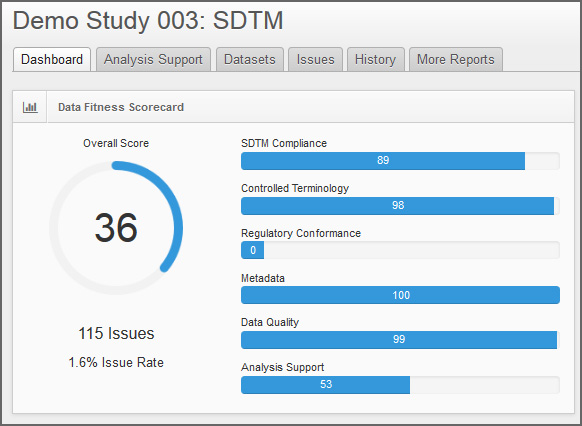
検証結果のダッシュボード画面 - エラー項目を効果的に管理・共有し、課題解決を強力に支援
臨床・非臨床試験データがCDISC標準に準拠していなかった項目は、対応の優先度とともに一覧でエラー表示されます。また、項目ごとに担当者を割り付けることが可能です。関連項目は分類表示され、コメント機能で注意事項やアドバイスを受けることもできるため、担当者は効率よく課題に対処することができます。
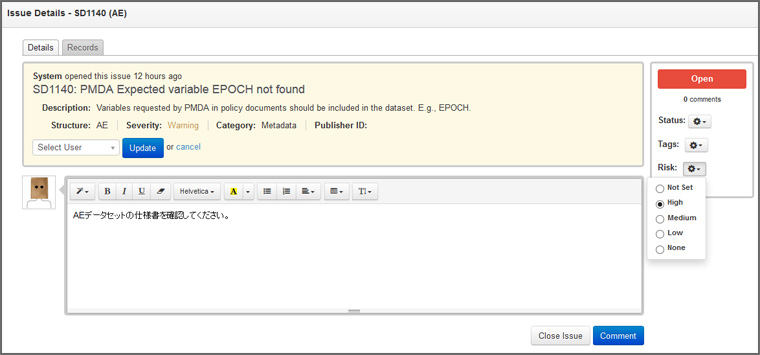
エラー表示された項目について担当者を割り当て、コメントを付ける画面 - 臨床・非臨床試験データの属性定義情報(Define-XML)を容易に作成可能
臨床・非臨床試験データを提出する際には、それらのデータ属性を定義した情報「Define-XML」も提出が求められます。「Pinnacle 21 Enterprise」を使えば、臨床・非臨床試験データをアップロードするだけで、容易にこの「Define-XML」を作成できます。また、「Define-XML」の自動作成中に、属性情報が不足している箇所がリアルタイムで表示されるため、担当者はエラー表示された項目に順次属性情報を追加していくことができます。
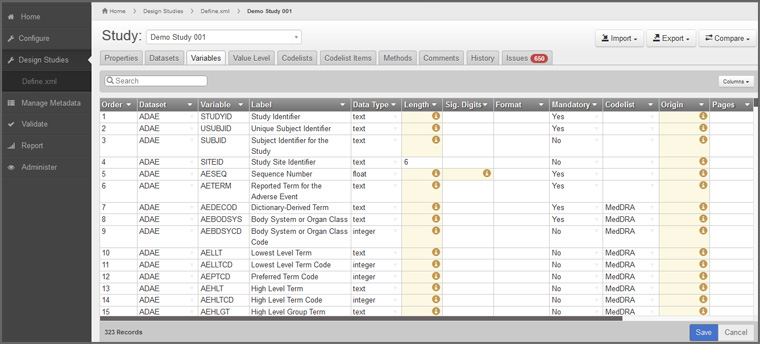
「Define-XML」で不足している属性情報をリアルタイムでエラー表示
【販売価格(税別)】
620万円より
【販売目標】
今後3年間で50社
【商標について】
記載されている製品名などの固有名詞は、各社の商標または登録商標です。
【注釈】
|
(注1) |
CDISC:Clinical Data Interchanges Standards Consortiumの略で、臨床研究に関わるデータ・メタデータの取得、交換、申請、アーカイブに関する一連のデータ標準を定めるNPO団体 |
|
(注2) |
わずか数分:CDISCで公開されているUpdated Pilot Submission Packageのデータで検証した場合 |
【関連URL】
「tsClinical Metadata」について
http://www.fujitsu.com/jp/solutions/industry/life-sciences/products/drug-development/metadata/index.html
以上
プレスリリースに記載された製品の価格、仕様、サービス内容、お問い合わせ先などは、発表日現在のものです。その後予告なしに変更されることがあります。あらかじめご了承ください。
お客様お問い合わせ先
株式会社富士通システムズ・イースト
第一産業ソリューション本部 第二事業部 第一ソリューション部
![]() 電話:03-6712-3739(直通)
電話:03-6712-3739(直通)
受付時間:9時~17時30分(土曜日・日曜日・祝日・年末年始を除く)
報道関係お問い合わせ先
株式会社富士通システムズ・イースト
ビジネスマネジメント本部 グループマネジメント推進統括部
![]() 電話:03-6712-3701(直通)
電話:03-6712-3701(直通)