PRESS RELEASE (サービス)
2019年10月30日
富士通株式会社
日本初、医薬品の申請電子データを自動作成する
「tsClinical for SDTM Automation」を提供開始
申請電子データの利活用推進支援により日本の革新的な新薬創出に貢献
当社は、医薬品の申請電子データを標準規格のSDTM(Study Data Tabulation Model)形式に自動作成するソリューション「tsClinical for SDTM Automation」(ティーエスクリニカル フォー エスディーティーエム オートメーション)」(以下、「SDTM Automation」)を開発し、国内の製薬企業向けに10月30日より提供開始します。
本ソリューションは、製薬企業が医薬品の承認申請の際に規制当局へ提出する申請データを、臨床試験データのグローバルスタンダードを策定する団体であるClinical Data Interchange Standards Consortium(以下、CDISC)が掲げる標準規格のSDTM形式にシステム上で自動作成できるため、人手による作業ミスや標準規格の理解のばらつきを防ぎ、SDTM形式での申請電子データ(以下、SDTMデータ)作成業務のコスト削減、および品質強化を実現します。
国内の規制当局である独立行政法人医薬品医療機器総合機構(Pharmaceuticals and Medical Devices Agency、以下、PMDA)(注1)は、2020年4月からSDTM形式での電子申請を義務化します。当社は、本ソリューションを提供することで、SDTMデータの自動作成(特許出願済)を世界に先駆けていち早く対応します。これにより、製薬企業各社が抱えるSDTMデータの品質担保や作成リソースの確保、作成コストの抑制などの課題を迅速に解決するとともに、PMDAによる臨床データの活用推進を支援し、日本の革新的な新薬創出に貢献します。
背景
製薬企業から提出される医薬品などの承認審査を行うPMDAは、革新的な医薬品の創出に向けて臨床試験データを活用するため、SDTMデータの提出を2020年4月から義務化します。この動きに対応するため、製薬企業や治験業務の受託機関では、SDTMデータの作成および作成手順や体制作りが急務となっています。
現在、SDTMデータの作成はシステム化されておらず、臨床試験データを電子的に収集するElectronic Data Capture(以下、EDC)システムや、ほかのシステムで収集された様々な形式のデータから、製薬企業の担当者が手作業で試験ごとに変換仕様書とプログラムを作成しています。そのため、人手による作業ミスの発生や、1試験あたり約1,000万円(注2)掛かる作成コストの負担が問題となっています。また、SDTMガイドライン(注3)では標準規格の理解にばらつきが生じるケースもあり、作成後の手戻りが発生するリスクや、標準規格を理解した人材の確保も課題となっています。さらに受託機関においても、製薬企業から集中した依頼へのリソースが確保できず、対応困難な状態が起きており、国内の製薬企業による医薬品申請の遅延といった社会課題も懸念されています。
本ソリューションの主な特長
- 変換仕様書の一元管理による申請データの品質向上と申請準備期間の短縮
SDTMデータを作成する際に必要となる製薬企業各社標準の変換仕様書を、当社が提供する臨床試験メタデータ管理システム「tsClinical Metadata」上に設定し一元管理するため、SDTMデータの作成に一貫性を持たせることができます。これにより、作業者ごとの標準規格の理解や記載項目のばらつきなどによる作業ミスを防止し、SDTMデータの品質の均一化が図れます。また、プログラミングレスでSDTMデータの作成が行えるため、従来人手で行っていた変換プログラムの作成や動作確認、およびプログラム実行後のデータチェック作業が削減され、申請までの準備期間が短縮できます。
- 自動化による手作業の軽減とSDTMデータ作成業務コストの削減
製薬企業各社標準の変換仕様書をもとにシステム上で試験ごとの変換仕様書が作成できるため、変換仕様書の作成負荷を軽減します。また変換仕様書の作成中に、データの整合性チェックを実行する機能を搭載しているため、作業ミスによる手戻り作業を防止し、効率的な作成管理が可能です。さらに、変換仕様書とその作成元となる臨床試験データを含めたSDTMデータ一式について、いつ誰が作成したかなどのログもシステム上で版数管理できるため、製薬業界で求められるトレーサビリティを確実に担保でき、規制当局からの査察対応の効率化に貢献します。これらにより、医薬品承認申請における臨床試験の計画から申請準備までの業務のコストを削減します。
- EDCシステムなどの各種収集システムからの幅広いデータに対応
本ソリューションは、当社の臨床試験向け症例データ収集システム「tsClinical DDworks21/EDC plus(ディーディーワークス21 イーディーシー プラス)」のユーザー向けにオプション製品として提供も可能とするほか、他社製のEDCシステムや臨床検査を行う外部機関で収集されたデータにも対応可能(注4)です。これにより、現在使用している各種データ収集システムに制限されることなく、SDTMデータの作成が可能です。
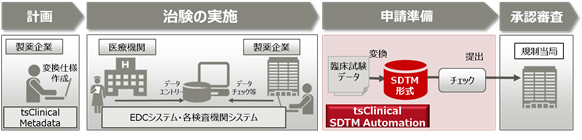
治験の計画から承認申請までの流れ
拡大イメージ
販売価格、および出荷時期
| 製品・サービス名 | 販売・提供価格(税別) | 出荷・提供時期 |
|---|---|---|
| 「tsClinical for SDTM Automation」 | 個別見積り | 10月30日より |
販売目標
2020年度末までに100試験。
今後について
今後、SDTMデータ作成における変換仕様書の自動作成など機能を拡大し、日本の医薬品申請業務のさらなる効率化と試験成功率の向上に貢献するとともに、当社の治験分野におけるビジネス拡大につなげていきます。
商標について
記載されている製品名などの固有名詞は、各社の商標または登録商標です。
以上
注釈
- 注1 独立行政法人医薬品医療機器総合機構:
- 厚生労働省所管の独立行政法人。医薬品や医療機器などの品質、有効性および安全性について、治験前から承認までを一貫した体制で指導・審査し(承認審査)、市販後における安全性に関する情報の収集、分析、提供を行う機関。
- 注2 1試験あたり約1,000万円:
- 当社調べ(2019年10月4日現在)。
- 注3 SDTMガイドライン:
- SDTMデータ作成者向けの作成ガイドライン
- 注4 他社製のEDCシステムや臨床検査を行う外部機関で収集されたデータにも対応可能:
- 「tsClinical Metadata」の導入が前提。かつ、全ての他社製品に対応するものではありません。対応システムについは製品サイトよりお問合せください。
関連リンク
本件に関するお問い合わせ
富士通コンタクトライン(総合窓口)
![]() 0120-933-200
0120-933-200
受付時間: 9時~17時30分(土曜日・日曜日・祝日・当社指定の休業日を除く)
プレスリリースに記載された製品の価格、仕様、サービス内容、お問い合わせ先などは、発表日現在のものです。その後予告なしに変更されることがあります。あらかじめご了承ください。