PRESS RELEASE(事例)
2017年2月16日
富士通株式会社
国立がん研究センター東病院様の最先端の医師主導治験を支援する
「tsClinical DDworks21」が稼働
治験薬の安全性情報の確実な伝達を実現し、医療安全の向上に貢献
当社は、国立研究開発法人国立がん研究センター東病院(所在地:千葉県柏市、院長:大津敦、以下 国立がん研究センター東病院)様に、治験業務を支援する「FUJITSU ライフサイエンスソリューション tsClinical DDworks21(ティーエスクリニカル ディーディーワークス21)」(以下、「tsClinical DDworks21」)シリーズの治験薬の安全性情報の収集・伝達を管理する「tsClinical DDworks21/NSADR(エヌエスエーディーアール)」と、治験関連文書を管理する「tsClinical DDworks21/TMF(ティーエムエフ)」を提供し、このたび国立がん研究センター東病院様での本格稼働を開始しました。
国立がん研究センター東病院様では、「tsClinical DDworks21/NSADR」により、各治験施設で発生した重篤な有害事象(注1)などの安全性情報を関係者間で迅速に収集・伝達できるようになり、伝達事項の受領記録や質疑応答履歴、責任医師の判断結果などの一元管理が可能になりました。また、「tsClinical DDworks21/TMF」により、安全性情報を含む100種類近くの治験関連文書を電子保管し一覧化できるほか、電子署名を用いた文書承認のワークフローをシステム上で実現しています。
当社は、本システムの活用により、国立がん研究センター東病院様の医療安全に配慮した信頼性の高い治験業務を支援し、新たな薬や医療技術の研究開発の促進に貢献してまいります。
背景
国立がん研究センター東病院様は、日本に8カ所ある臨床研究中核病院(注2)の1つとして、治療に携わる医師が自ら、未承認抗がん剤を含んだ治験を行う医師主導治験(注3)を実施しています。
これまで、国立がん研究センター東病院様では、治験施設で発生した重篤な有害事象や、製薬会社からもたらされる海外症例などの安全性情報の治験施設間の共有を、紙文書やメールなどで行っていました。また、安全性情報を含め100種類近く存在する膨大な治験関連文書を人手で整理するなど、多大な手間がかかっていました。
今回当社は、このような課題に対し、「tsClinical DDworks21/NSADR」と「tsClinical DDworks21/TMF」を組み合わせて提供することで、安全性情報の確実な収集・伝達と治験関連文書の一元管理を可能とし、国立がん研究センター東病院様の医療安全に配慮した信頼性の高い治験業務に貢献します。
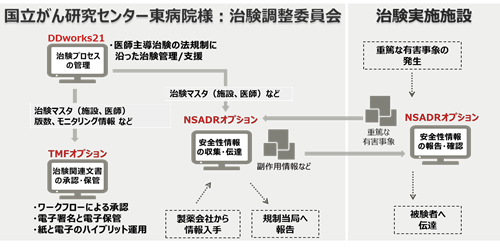
図.導入システム概要
拡大イメージ
導入効果
- 安全性情報の確実な伝達を実現
治験業務においては、各治験施設で発生した重篤な有害事象や、治験薬提供元の製薬会社からもたらされる海外の副作用情報などを迅速に収集し、治験を行う関係者に伝達することで、被験者の安全を確保することが求められています。国立がん研究センター東病院様では、「tsClinical DDworks21/NSADR」を導入することで、従来の紙文書やメールでの伝達によって共有していた方法から、システム上で受領確認や質疑応答のやりとり、責任医師の判断にいたる一連の流れを管理できるようになり、迅速かつ確実な安全性管理業務を実現しました。
- 膨大な治験関連文書の一元管理を実現
治験では、安全性情報を含め、100種類近くの文書を作成します。国立がん研究センター東病院様では、従来、各治験施設からメールなどで入手した文書を手作業でファイリングしており、非常に手間がかかっていました。今回導入した「tsClinical DDworks21/TMF」により、治験関連文書を電子保管し、自動で一覧化することが可能になりました。また、従来は、関係者の承認を得るために、プリントアウトした紙文書を回送していた工程が、ワークフローと電子署名で行えるようになり、スムーズな承認手続きを実現しました。
商標について
記載されている製品名などの固有名詞は、各社の商標または登録商標です。
以上
注釈
- 注1 重篤な有害事象:
- 治験薬を投与された被験者に生じた好ましくない医療上のあらゆる出来事(当該治験薬との因果関係の有無は問わない)の中で、死亡、死亡のおそれ、入院又は入院期間の延長、障害、先天異常、これらに準じて重篤な事象のこと。
- 注2 臨床研究中核病院:
- 日本発の革新的医薬品・医療機器の開発などに必要となる質の高い臨床研究を推進するため、国 際水準の臨床研究や医師主導治験の中心的役割を担う病院。
- 注3 医師主導治験:
- 製薬会社が主導する企業治験とは異なり、国内未承認薬や適用外使用などの承認申請を目的に医師 が自ら実施する治験。
関連リンク
本件に関するお問い合わせ
西日本ビジネスグループ
グローバルビジネス本部 ライフサイエンス事業部
![]() ddworks21@cs.jp.fujitsu.com
ddworks21@cs.jp.fujitsu.com
プレスリリースに記載された製品の価格、仕様、サービス内容、お問い合わせ先などは、発表日現在のものです。その後予告なしに変更されることがあります。あらかじめご了承ください。