PRESS RELEASE (サービス)
2014年9月25日
富士通株式会社
大手製薬企業のノウハウを反映させた新しい非臨床安全性試験パッケージ
「tsPharma LabSite」を販売開始
豊富な機能を有し、法規制の変化や今後の電子化申請への柔軟な対応を実現
当社は、新薬研究・開発分野ソリューションの強化として、製薬業界や医薬品開発業務試験受託機関向けに、新しい非臨床安全性試験パッケージ「FUJITSU Life Science Solution tsPharma LabSite(フジツウ ライフサイエンスソリューション ティーエスファーマ ラボサイト)」(以下、tsPharma LabSite)を9月25日より販売開始します。
本製品は、当社のこれまでの非臨床試験分野のパッケージ開発の実績に加え、大手製薬企業の武田薬品工業株式会社(本社:大阪府大阪市、代表取締役社長:クリストフ ウェバー)様と第一三共株式会社(本社:東京都中央区、代表取締役社長:中山 讓治)様による協力を得て、開発したものです。開発協力を通じ、試験実施手順などの現場のノウハウと実際に利用している独自開発のシステム資産をフル活用し、機能の充実を図りました。
特長的な機能として、GLP(注1)およびPart11(注2)に準拠するとともに、実際に試験時に使用している400種類以上の帳票レイアウトを標準テンプレートとして提供するほか、今後予定されている電子化申請にも対応しています。さらに、新たにICH S2(R1)ガイドライン(注3)で採用されたin vitro小核試験を含むICH M3(R2)ガイドライン(注4)で規定された10種類の試験種と、試験データ検索やスケジュール管理などの11種類のオプション機能、およびクライアントライセンス数を、それぞれ組み合わせて利用することができ、GLP適用試験のみならず、GLP非適用での用量設定試験や探索的・毒性機作検討試験まで、柔軟かつ最適なシステム構成での導入が可能です。
これにより、新薬研究・開発における膨大な作業を効率よく進めることができるほか、今後のシステム拡張や法規制などにも柔軟に対応し、将来にわたり安心して利用できます。
非臨床試験とは
人体に直接使用される薬は、発売されるまでに非常に長い研究年月と多額の開発費用をかけて、その有効性と安全性の評価が行われています。研究から発売までの流れは、薬のモトとなる新規物質の創出を行う「基礎研究」から始まり、動物や培養細胞を用いた「非臨床試験」、ヒトを対象とした「臨床試験」を経て、厚生労働省への「承認申請」と専門家による「承認審査」、さらに「製造販売後調査」という形で行われています。
非臨床試験においては、臨床試験の前段階として、動物などに薬の候補物質を与えて評価を行う様々な試験が実施されています。摂取させる候補物質の量、時間経過などの諸条件下にて、多岐にわたる観察を行い、最終的には解剖、病理検査などを経て、統計処理を含めた候補物質の評価が行われています。これらの安全性試験を適切に実施するための基準として、日本においては厚生労働省が「医薬品の安全性に関する非臨床試験の実施の基準に関する省令」を定めており、非臨床試験の実施に関する信頼性確保が義務づけられています。
背景
非臨床試験で利用されるコンピュータシステムにおいては、試験計画から試験の実施、結果データの取得、評価における信頼性保証の記録やデータ訂正記録、改ざん防止の機能の実装など様々な条件が求められます。
当社は、1980年に非臨床試験のコンピュータシステム化への取り組みを開始し、1992年から安全性試験システムパッケージ「LATOX-F(ラトックス エフ)」を提供してきました。昨今では、投資抑制や動物愛護の動向などから、製薬企業のGLP適用試験のアウトソーシング化の増加や使用動物数を減らした試験内容への変更が実施されています。また、ICH動向、規制要件変更や今後の電子化申請への対応など、様々に情勢が変化する中で、柔軟に対応できるシステムが求められています。これらの背景を受け、柔軟性があり、かつ広く共通的に使える非臨床試験の業界標準システムを目指し、「tsPharma LabSite」を開発しました。
当社の製薬業界向けライフサイエンスソリューション
当社は、新薬研究・開発における有効性と安全性の評価を支援するライフサイエンスソリューションとして、基礎研究から製造販売後調査までのそれぞれに対応した豊富なラインナップをとりそろえ、安全で有効な新薬の開発を強力に支援していきます。
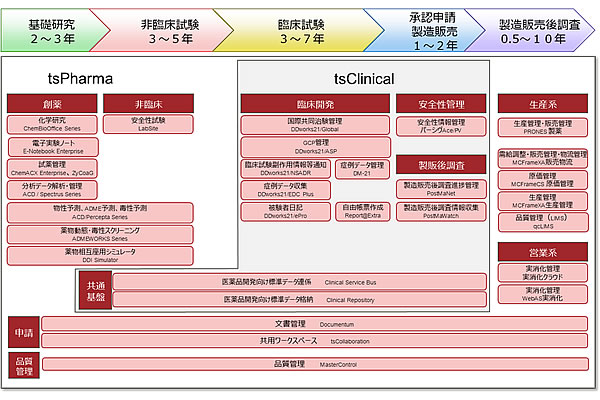
図1. 当社の製薬業界向けライフサイエンスソリューション体系
拡大イメージ
製品概要
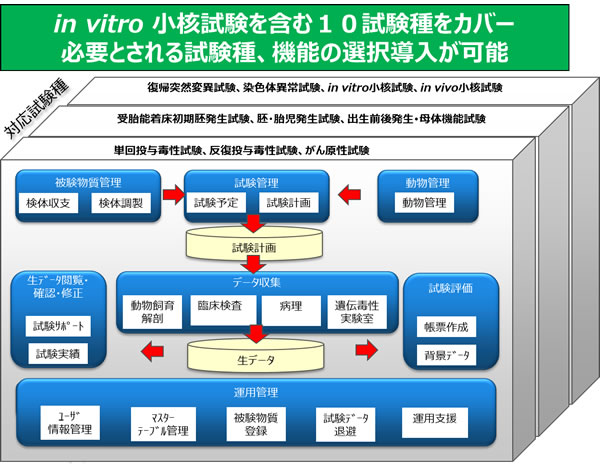
図2. 「tsPharma LabSite」の機能体系
拡大イメージ
- 現場のノウハウを反映した多様な機能を搭載
- 豊富な出力票を搭載
実際に使用している400種類以上の帳票レイアウトを標準テンプレートとして用意しています。また、標準テンプレートはお客様ごとにレイアウト編集や追加することができ、ニーズの高い帳票カスタマイズにも対応します。
- GLP非適用試験・非定型試験に対応
GLP適用試験に準拠しているのはもちろん、今回、柔軟な試験計画機能により、GLP非適用試験や非定型試験にも対応し、通常測定項目にはない任意の測定を追加することや、試験途中での測定項目の追加などが可能です。また、反復投与毒性試験の機能を用いた局所刺激性試験、in vivo光毒性試験の実施へと適用範囲を広げることで、お客様の業務効率化を実現します。
- 豊富な出力票を搭載
- 電子化申請に対応
Part11に準拠するとともに、現在進められている申請電子データの標準化(SEND IG V3.0)に対応しています。今後のガイダンス追加などにも適宜対応を行っていきます。
- 必要機能の選択導入による最適構成を実現
安全性試験で要求される10種類の試験種と、試験データ検索やスケジュール管理などの11種類のオプション機能、クライアントライセンス数を、それぞれ組み合わせて利用することができます。お客様ごとの運用に即した最適なシステム構成での導入が可能です。
- データを安全に保管するためのデータ集中・分散方式を採用
通常時はサーバとクライアント端末が常時接続されたサーバデータ集中方式で稼働していますが、トラブルや定期保守などによりサーバやLANが停止した場合には、サーバとクライアント端末を切り離し(データ分散方式)、クライアント端末によるデータ収集を行います。これにより、安全性試験業務を安定的に継続することが可能です。
販売価格および販売時期
| サービス名 | 販売価格(税別) | 販売時期 |
|---|---|---|
| tsPharma LabSite V1 | 1,450万円から(最小構成価格) *以下の構成の場合 tsPharma LabSite V1 サーバライセンス ×1 tsPharma LabSite V1 クライアントライセンス ×5 tsPharma LabSite V1 単回投与毒性試験 ×1 tsPharma LabSite V1 反復投与毒性試験 ×1 |
9月25日より |
販売目標
3年間で25社。
商標について
記載されている製品名などの固有名詞は、各社の商標または登録商標です。
以上
注釈
- 注1 GLP:
- Good Laboratory Practice。医薬品の安全性に関する非臨床試験の実施基準。
- 注2 Part11:
- FDA 21 CFR Part11(アメリカ食品医薬品局の連邦法第21章第11条)。米国の医薬品や食品の販売許可申請の際に使用する電子データと電子署名について、遵守すべき要件を定めた規則。
- 注3 ICH S2(R1)ガイドライン:
- ICHは、International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use(日米EU医薬品規制調和国際会議)。S2(R1)ガイドラインは、ICHで定められた医薬品の遺伝毒性試験および解釈に関するガイダンス。
- 注4 ICH M3(R2)ガイドライン:
- ICHで定められた医薬品の臨床試験及び製造販売承認申請のための非臨床安全性試験の実施についてのガイダンス。
本件に関するお問い合わせ
富士通コンタクトライン
![]() 0120-933-200
0120-933-200
受付時間: 9時~17時30分(土曜日・日曜日・祝日・年末年始を除く)
プレスリリースに記載された製品の価格、仕様、サービス内容、お問い合わせ先などは、発表日現在のものです。その後予告なしに変更されることがあります。あらかじめご了承ください。